帕金森病(Parkinson’s disease, PD)是除了阿尔茨海默病之外,世界第二大的神经退行性疾病。为了纪念发现这一疾病的英国医生詹姆斯·帕金森,人们将他的生日——4月11日确定为“世界帕金森日”。
帕金森病的主要症状表现为运动障碍,如运动迟缓(bradykinesia)、僵直(rigidity)、静止性震颤(tremor)等。除此之外帕金森患者也表现出了感觉障碍和认知功能障碍等非运动症状。一项2016年的研究显示,60岁以上老年人群中帕金森病的患病率约为1%-2%;而在80岁以上人群中,这一比例则会上升至4%左右1。目前,我国的帕金森患者已经达到了200万人,占全世界帕金森病人的一半左右。在我国老龄化逐步加深的背景下,帕金森病已经成为威胁老年人群身心健康的一大“杀手”。
帕金森病最为突出的病理改变是中脑黑质中多巴胺能神经元的变性和死亡。另外人们发现,残存神经元中路易小体的形成和α-突触核蛋白的聚集也是帕金森病的典型特征之一。帕金森病的病因至今未明,证据显示遗传、环境污染、衰老等因素均在帕金森病的发生中扮演了一定的角色。
为了研究帕金森病的发病原因以及探索新的临床的治疗手段,制备有效的帕金森病动物模型有着重要的意义。在本文中我们将介绍3种主流的帕金森病的动物模型的原理和制备方法。而在下期,我们将介绍检验大小鼠帕金森模型造模效果的病理和行为学方法。
1982年,7个来自加利福尼亚州圣克拉拉县的“嬉皮士”在吸食了一种合成毒品后被紧急送往医院救治。医生惊奇地发现,这7位患者虽然年纪轻轻,行动却像百岁老人一样迟缓,并伴随有肢体震颤的现象,和帕金森病的表现十分相似。进一步的检验表明,这批合成毒品中含有一种名为1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine, MPTP)的杂质2。1984年,斯坦福大学的神经学家威廉·兰斯顿确认MPTP正是导致这些年轻人出现帕金森样症状的罪魁祸首3。
从原理来看,MPTP本身对细胞并无毒害作用。但是当MPTP进入体内后,由于自身良好的脂溶性,MPTP可以轻易穿过血脑屏障(blood-brain barrier, BBB)进入中枢神经系统4。而在脑中,MPTP会被神经胶质细胞中的单胺氧化酶B(MAO-B)代谢为一种名为MPDP +的中间体。而该中间体再经过进一步的氧化,最终形成有毒的代谢物甲基-苯基四氢吡啶鎓盐(MPP +)5。
MPP+的结构接近多巴胺,因此会错误地被中脑多巴胺神经元膜上的多巴胺转运体(dopamine transporter, DAT)选择性重吸收进入细胞内6。而一旦进入细胞,MPP+则会“凶相毕露”,它会抑制线粒体呼吸链复合体I的活性7,从而阻断电子转移链,减少ATP的生成并促进活性氧(reactive oxygen species, ROS)的产生,最终造成神经元的损伤8。
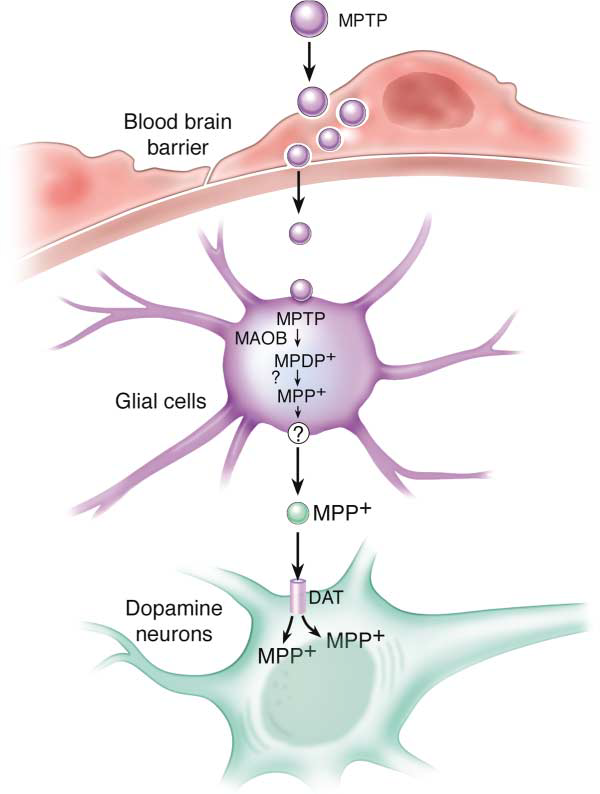
图1 MPTP的代谢途径和MPP+在胞内的路径
正因为MPTP是第一个也是目前仅能够在人类身上复现帕金森症状的神经毒素(某种意义上还要感谢这几位加州的年轻人),MPTP诱导的帕金森模型成为了在模式动物上研究帕金森病临床疗法的“金标准”,尤其是MPTP诱导的非人灵长类(如恒河猴)帕金森模型。而MPTP诱导的小鼠帕金森模型由于造模技术相对简单(只需要腹腔注射)、对多巴胺神经元的杀伤效果稳定也得到了广泛的认可。不少关于多巴胺能神经元死亡机制方面的研究都采用MPTP诱导的小鼠帕金森模型作为实验范式。
动物:雄性C57BL/6,大约7-8周龄,体重25-30 g。注意MPTP诱导的小鼠帕金森模型对动物的性别、体重、年龄甚至品系来源(是Jackson lab还是Charles River)均非常敏感。在挑选动物的时候要十分小心。
饲养:订购的动物到位后,在注射前务必适应性饲养1周左右。因为长距离运输会改变脑的状态,因此需要5-7天时间来使动物恢复并适应环境。
注射:在注射当天配制好新鲜的MPTP溶液,然后每只动物按14-20 mg/kg体重的剂量腹腔注射MPTP。间隔2小时后进行下一次注射,当天共进行4次注射。
术后护理:注射之后大约30分钟,小鼠就会出现类似帕金森的症状,如强直或震颤等。而在大约3小时后未被代谢的MPTP将会随着动物的排泄物被释放到垫料中。因此在注射之后小鼠需要进行严格的隔离饲养。其使用的垫料、饮水必须经过无害化处理,然后作为医疗垃圾废弃。大约3-4周后可以对动物的病理和行为表现进行检测。
6-羟多巴胺(6-hydroxydopamine, 6-OHDA)是多巴胺的羟基化衍生物,于1959年首先被Senoh等人成功分离9。自发现以来的半个多世纪中,6-OHDA一直在帕金森病的临床前研究中扮演着重要角色。由Ungerstedt和Arbuthnott在1970年共同创立的单侧注射旋转模型成为了在模式动物上被最为广泛使用的帕金森模型之一10。 6-OHDA对神经元的毒害作用有一个“两步走”的过程。第一步是特异性地在多巴胺能神经元内的积累。由于6-OHDA的结构和儿茶酚胺类似,因此释放在细胞间质中的6-OHDA会被多巴胺神经元胞体或突起上的多巴胺转运体或NAT错误地识别并重吸收进入细胞(图2)。第二步则是细胞毒性。当6-OHDA进入神经元后,一方面将会被单胺氧化酶-A(MAO-A)催化形成过氧化氢(H2O2)。过氧化氢本身具有很强的细胞毒性,同时也会触发氧自由基的形成12。而另一方面,自动氧化(autooxidation)作用所大量产生的活性氧和醌类产物超出了细胞内抗氧化酶的承受能力,导致细胞结构和代谢的紊乱,最终结果就是神经元的损伤(图2)。
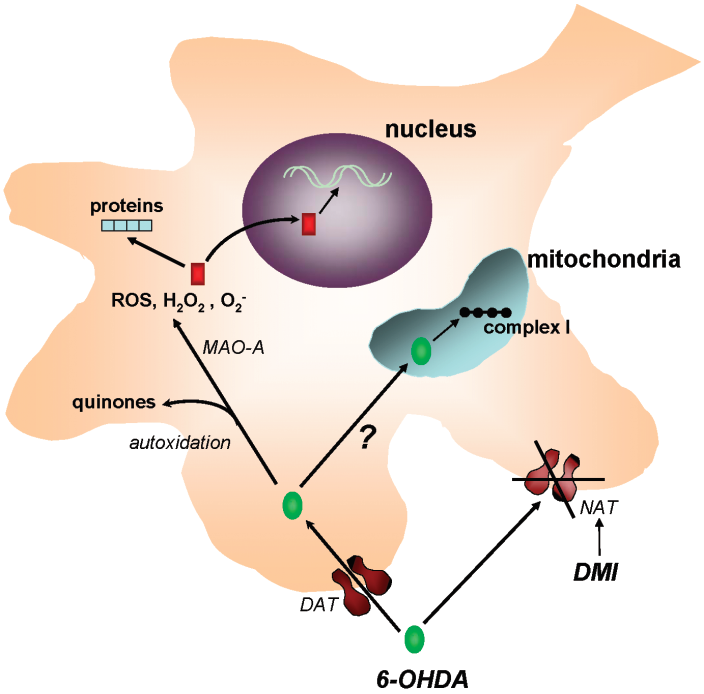
图2 6-OHDA介导的神经毒性作用机制
术后护理:脑定位注射完成后将动物放在加热板或灯光下照射保持体温。待动物苏醒后放回笼中。术后3天内每天腹腔注射一次抗生素。大约3-4周后可以进行行为学检测。
除了多巴胺神经元丢失之外,帕金森病的另一种典型的神经病理标志是残存的神经元胞质内出现一种嗜酸性的包涵体,即路易小体(Lewy bodies, LBs)。显微镜下呈现圆形的粉红色均质结构。路易小体的主要组成成分是一种叫做α-突触核蛋白(α-synuclein, α-Syn)的突触前蛋白。大量证据显示,α-突触核蛋白的聚集和路易小体的形成与多巴胺神经元的死亡有着密切的联系13。α-突触核蛋白由SNCA基因编码,是一种主要表达在突触前和核周的可溶性蛋白。α-突触核蛋白的确切功能至今仍不清楚,不过有证据显示可能与突触可塑性或神经递质释放相关。正常状态下的α-突触核蛋白以单体(monomers)或者α螺旋状(α-helical)折叠的四聚体形式存在,可溶并且鲜有聚集的情况;但在病理状态下,α-突触核蛋白会改变构象为富含β片状(β-sheet)折叠的结构。错误折叠的α-突触核蛋白会聚集起来形成寡聚体,并逐渐向纤维原和不溶性纤维的形态发展,最终沉积在路易小体中。除此之外,大量研究证据表明,错误折叠的α-突触核蛋白可以表现出朊病毒(prion)的性质,诱发内源α-突触核蛋白的错误折叠和聚集,并通过细胞间传递的方式在神经元之间扩散。 相比于使用神经毒素杀伤多巴胺神经元的帕金森模型,基于α-突触核蛋白的帕金森病模型由于在时程上能够较好地模拟帕金森病发生、发展的全过程,这有利于发现和识别新的治疗靶点。在诸多基于α-突触核蛋白的帕金森模型中,近年来被最广泛使用的模型可以归纳为2种:预制纤维(pre-performed fibrils, PFFs)和AAV病毒颗粒模型。使用α-突触核蛋白的预制纤维进行造模首先需要制备PFFs。简而言之,预制纤维首先在体外由重组的α-突触核蛋白单体生成。接下来,聚集成原纤维的α-突触核蛋白被提取出来并超声破碎为短纤维的形式14。使用脑立体定位注射的方式将PFFs注射进脑内,在大约12周后将会诱发内源α-突触核蛋白的聚集、磷酸化和泛素化反应。 另一种有效的方式是使用重组腺相关病毒(recombinant adeno-associated virus, rAAV)外源过表达野生型或点突变型(如A53T)α-突触核蛋白。值得注意的的是,构建AAV载体采用的血清型和启动子,以及病毒注射的滴度和剂量都会对α-突触核蛋白过表达的效率产生影响15。目前的研究显示,使用常用的CMV或者hSyn启动子均可以提供高水平的基因表达效率。另外,使用一些转录后调控元件,如土拨鼠肝炎病毒转录后调节序列(WPRE)或者poly(A)尾巴同样可以显著提高转基因的效率。
动物:6-8周龄的C57/BL小鼠或PD相关的转基因鼠,雌雄不限,体重20-25 g左右。
饲养:动物订购之后需要至少适应性饲养1周后再进行脑定位注射。
脑定位注射:使用10 μL,33G的Hamilton注射器预先吸入2.5 μL左右α-突触核蛋白PFFs,其中α-突触核蛋白纤维的含量约为5 μg。动物开颅和调平操作于6-OHDA注射一致。α-突触核蛋白通常被单侧注射在纹状体(AP +0.2 mm; ML ±2.00 mm; DV -2.60 mm)。注射针缓慢插入注射位点,以0.1 μL/min的速度将PFFs注射到目标脑区。注射结束后,注射针应该继续停留在注射位点5分钟左右以使纤维充分扩散。最后提起注射针,将动物的头皮缝合并消毒。 如果是病毒注射,则构建AAV2/1-A53T(人类α-突触核蛋白A53T点突变型)-EGFP-WPRE病毒载体,用注射器或玻璃电极吸取1.5 μL,滴度为2-3×1012 v.g./mL病毒,并以0.1 μL/min的速度单侧注射在黑质(AP -3.1 mm; ML -1.4 mm; DV -4.4 mm)。
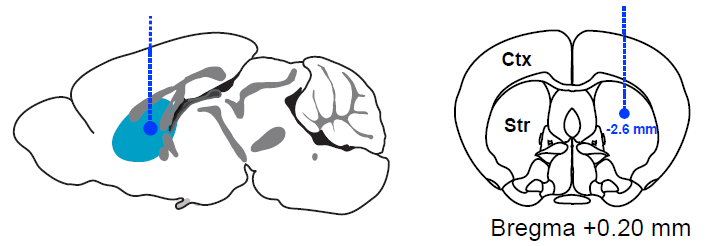
术后护理:脑定位注射完成后将动物放在加热板或灯光下照射保持体温。待动物苏醒后放回笼中。术后3天内每天腹腔注射一次抗生素。大约90天后动物会逐渐表现出帕金森表型。
[1]Rizek, P., Kumar, N., & Jog, M. S. (2016). An update on the diagnosis and treatment of Parkinson disease.CMAJ : Canadian Medical Association journal, 188(16), 1157–1165. https://doi.org/10.1503/cmaj.151179
[2]Ballard, P. A., Tetrud, J. W., & Langston, J. W. (1985). Permanent human parkinsonism due to 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP): seven cases. Neurology, 35(7), 949–956. https://doi.org/10.1212/wnl.35.7.949
[3]Langston, J. W., Ballard, P., Tetrud, J. W., & Irwin, I. (1983). Chronic Parkinsonism in humans due to a product of meperidine-analog synthesis. Science (New York, N.Y.), 219(4587), 979–980. https://doi.org/10.1126/science.6823561
[4]Xu, L., & Pu, J. (2016). Alpha-Synuclein in Parkinson's Disease: From Pathogenetic Dysfunction to Potential Clinical Application. Parkinson's disease, 2016, 1720621. https://doi.org/10.1155/2016/1720621
[5]Burns, R. S., Chiueh, C. C., Markey, S. P., Ebert, M. H., Jacobowitz, D. M., & Kopin, I. J. (1983). A primate model of parkinsonism: selective destruction of dopaminergic neurons in the pars compacta of the substantia nigra by N-methyl-4-phenyl-1,2,3,6-tetrahydropyridine. Proceedings of the National Academy of Sciences of the United States of America, 80(14), 4546–4550. https://doi.org/10.1073/pnas.80.14.4546
[6]Mayer, R. A., Kindt, M. V., & Heikkila, R. E. (1986). Prevention of the nigrostriatal toxicity of 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine by inhibitors of 3,4-dihydroxyphenylethylamine transport. Journal of neurochemistry, 47(4), 1073–1079. https://doi.org/10.1111/j.1471-4159.1986.tb00722.x
[7]Davey, G. P., & Clark, J. B. (1996). Threshold effects and control of oxidative phosphorylation in nonsynaptic rat brain mitochondria. Journal of neurochemistry, 66(4), 1617–1624. https://doi.org/10.1046/j.1471-4159.1996.66041617.x
[8]Hasegawa, E., Takeshige, K., Oishi, T., Murai, Y., & Minakami, S. (1990). 1-Methyl-4-phenylpyridinium (MPP+) induces NADH-dependent superoxide formation and enhances NADH-dependent lipid peroxidation in bovine heart submitochondrial particles. Biochemical and biophysical research communications, 170(3), 1049–1055. https://doi.org/10.1016/0006-291x(90)90498-c
[9]Senoh S., Creveling C. R., Udenfriend S. and Witkop B. (1959) Chemical, enzymatic and metabolic studies on the mechanism of oxidation of dopamine. J. Am. Chem. Soc. 81, 6236–6240
[10]Ungerstedt, U., & Arbuthnott, G. W. (1970). Quantitative recording of rotational behavior in rats after 6-hydroxy-dopamine lesions of the nigrostriatal dopamine system. Brain research, 24(3), 485–493. https://doi.org/10.1016/0006-8993(70)90187-3
[11]Blum, D., Torch, S., Lambeng, N., Nissou, M., Benabid, A. L., Sadoul, R., & Verna, J. M. (2001). Molecular pathways involved in the neurotoxicity of 6-OHDA, dopamine and MPTP: contribution to the apoptotic theory in Parkinson's disease. Progress in neurobiology, 65(2), 135–172. https://doi.org/10.1016/s0301-0082(01)00003-x
[12]Reyes, J. F., Olsson, T. T., Lamberts, J. T., Devine, M. J., Kunath, T., and Brundin, P. (2015). A cell culture model for monitoring a-synuclein cell-to-cell transfer. Neurobiol. Dis. 77, 266–275. doi: 10.1016/j.nbd.2014.07.003
[13]Gómez-Benito, M., Granado, N., García-Sanz, P., Michel, A., Dumoulin, M., & Moratalla, R. (2020). Modeling Parkinson's Disease With the Alpha-Synuclein Protein. Frontiers in pharmacology, 11, 356. https://doi.org/10.3389/fphar.2020.00356
[14]Patterson, J. R., Polinski, N. K., Duffy, M. F., Kemp, C. J., Luk, K. C., Volpicelli-Daley, L. A., Kanaan, N. M., & Sortwell, C. E. (2019). Generation of Alpha-Synuclein Preformed Fibrils from Monomers and Use In Vivo. Journal of visualized experiments: JoVE, (148), 10.3791/59758. https://doi.org/10.3791/59758
[15]Oliveras-Salvá, M., Van der Perren, A., Casadei, N., Stroobants, S., Nuber, S., D'Hooge, R., Van den Haute, C., & Baekelandt, V. (2013). rAAV2/7 vector-mediated overexpression of alpha-synuclein in mouse substantia nigra induces protein aggregation and progressive dose-dependent neurodegeneration. Molecular neurodegeneration, 8, 44. https://doi.org/10.1186/1750-1326-8-44
